
以下文章来源于奇点网 作者:奇点神思
肠道微生物能促进阿尔茨海默病进展这一假说,又增加了一个大实锤。
近日,由华盛顿大学医学院david m. holtzman领衔的研究团队,在顶级期刊《科学》发表重要研究成果[1]。
他们基于小鼠模型发现,肠道微生物能以apoe基因型依赖的方式,促进tau蛋白介导的神经变性。与非无菌小鼠模型相比,无菌(gf)小鼠模型的脑萎缩显著减少。此外,抗生素处理也可以减轻小鼠模型的海马萎缩,不过这一现象在雌性小鼠中没有观察到。
这一发现为肠道微生物直接参与tau病理提供了坚实的证据。更重要的是,之前的研究已经发现肠道微生物参与了aβ病理和神经炎症,这一研究总算补齐了最后一块板子,说明肠道微生物直接参与了阿尔茨海默病的三大病理特征,为通过干预肠道微生物预防或治疗阿尔茨海默病奠定了基础。

论文pg电子官方首页截图
近十年来,肠道微生物与阿尔茨海默病之间的关系是研究热点。
有很多研究在小鼠模型中发现肠道微生物可以影响阿尔茨海默病的进展,而且无菌饲养或抗生素处理都可以减少aβ病理和小胶质细胞活化[2]。
我们都知道,阿尔茨海默病有三大病理特征:由aβ构成的斑块(aβ病理),由超磷酸化tau蛋白形成的神经纤维缠结(tau病理),以及导致神经变性的神经炎症[3]。然而,肠道微生物与tau病理的因果关系一直没有确认。要知道,tau病理与阿尔茨海默病患者的认知衰退密切相关。因此,搞清楚肠道微生物与tau病理的关系,对于阿尔茨海默病的预防和治疗将大有裨益。
holtzman团队注意到,肠道微生物的组成和功能受apoe的影响,而tau病理也受apoe基因型的调节,因此他们假设肠道微生物是以apoe依赖的形式调节tau病理相关的神经变性。

为了填补这最后一块空白,holtzman团队构建了特殊的小鼠模型。
他们首先在无菌条件下构建了既表达人源tau,又表达人源apoe4的小鼠模型(基因型为tau/apoe4,简称te4)。随后的饲养条件有三种:第一种是持续无菌饲养(gf);第二种是出生后就暴露于母鼠微生物中的常规饲养(conv-r)条件;第三种是无菌饲养到12周,然后口服40周龄te4的粪便微生物。所有小鼠在40周时被执行安乐死。
从小鼠的尸检结果来看,与携带apoe4基因,但没有tau基因的小鼠模型相比,常规饲养的te4小鼠出现了严重的区域性脑萎缩,表现为海马体积缩小和侧脑室扩大。
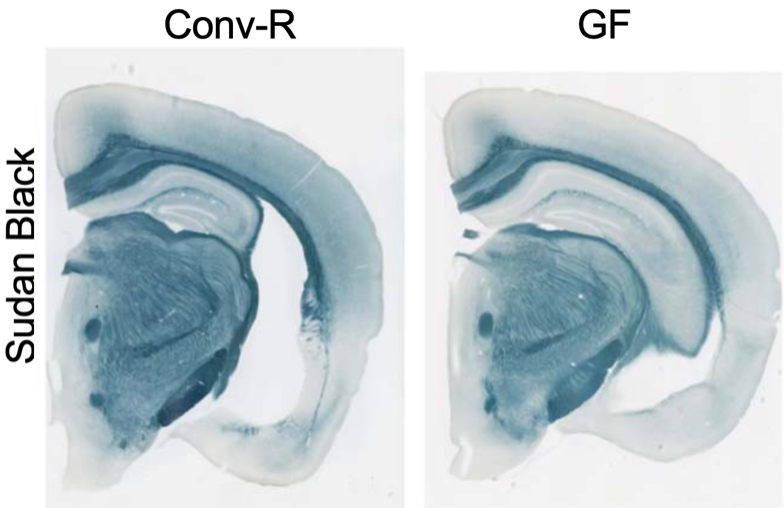
海马体积和侧脑室的比较
与常规饲养的te4小鼠相比,无菌饲养的te4小鼠脑组织损失较小。不过,那些无菌饲养12周后被移植常规饲养40周小鼠肠道微生物的小鼠,脑萎缩与一直常规饲养的te4小鼠一致。也就是说,无菌饲养的te4小鼠,一旦接触肠道微生物,它们大脑的萎缩就加剧了。
holtzman团队还用抗磷酸化tau抗体at8对小鼠大脑切片进行染色,发现与40周大的常规饲养小鼠相比,40周大的无菌饲养小鼠tau的磷酸化水平明显下降。
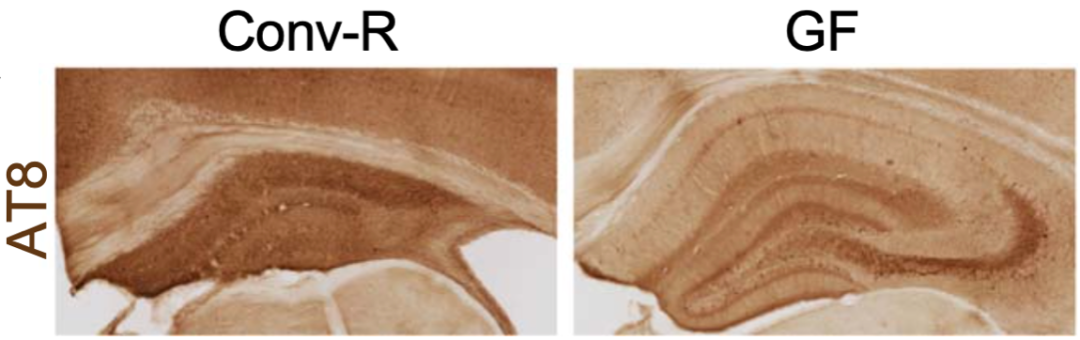
tau磷酸化水平比较
基于以上尸检结果,holtzman和他的同事认为,微生物群极大地影响了tau介导的神经变性。
那具体又是通过什么方式影响的呢?
基于前人的研究结果,holtzman团队发现虽然病理性磷酸化tau水平的升高可以直接导致神经元变性和死亡,但是越来越多的证据表明,反应性小胶质细胞和星形细胞是tau介导的神经变性所必需的[4]。因此,他们观察了小鼠大脑中小胶质细胞和星形细胞的变化。
结果发现,与常规饲养的雄性小鼠相比,无菌饲养小鼠海马中所有胶质细胞激活相关标志物的表达都强烈减少。不难看出,肠道微生物对小胶质细胞和星形胶质细胞反应性和激活的影响,与tau介导的神经变性密切相关。
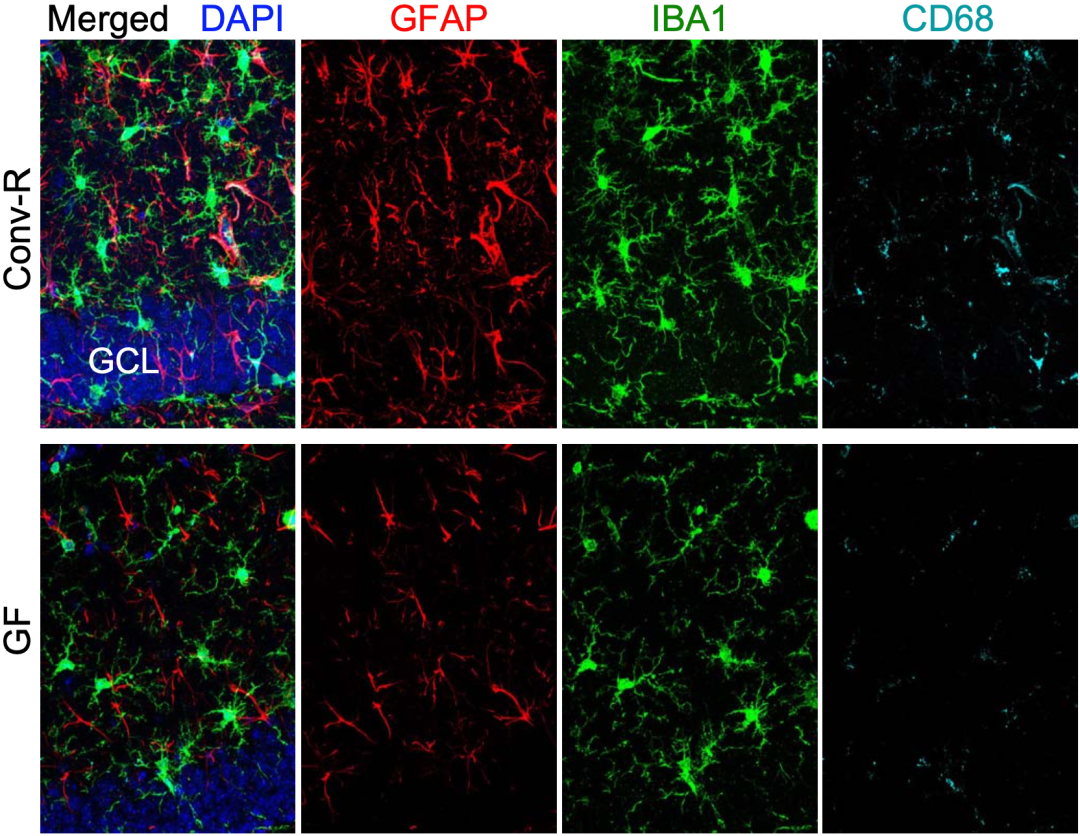
胶质细胞相关标志物的表达比较
既然如此,那后期的肠道微生物干预是否可以延缓甚至逆转tau介导的神经变性呢?
该抗生素出场了。holtzman团队选择了由卡那霉素、庆大霉素、多黏菌素e、甲硝唑和万古霉素组成的抗生素鸡尾酒(abx)。实验小鼠模型用了三种:te4(基因型为tau/apoe4)、te3(基因型为tau/apoe3)和teko(有tau,没有apoe)。小鼠从出生后的第16天到第22天,每天被灌服抗生素鸡尾酒(对照组灌水)。同样是在40周龄时执行安乐死。
研究结果显示:用抗生素治疗的雄性te3小鼠,星形胶质细胞和小胶质细胞形态更稳定;此外,所有雄性te3和te4小鼠在接受抗生素治疗后,磷酸化tau水平降低,海马萎缩明显减轻,反应海马功能的筑巢行为明显改善,尽管表达apoe3的小鼠比apoe4的效果更大。
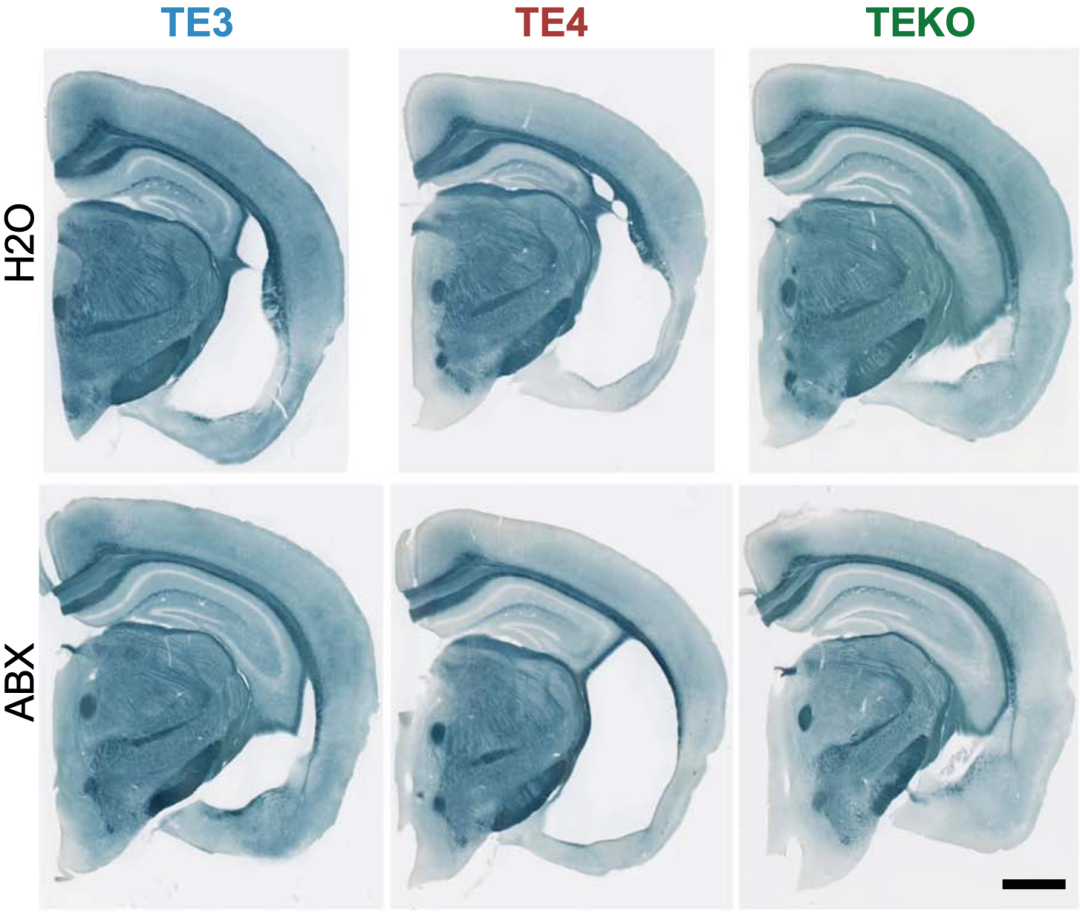
抗生素处理的效果
让holtzman团队感到意外的是,以上提到所有抗生素处理好处都发生在雄性身上,而不是雌性。
这一结果让他们想起了以前的一项研究结果:长期抗生素处理会导致雄性阿尔茨海默病小鼠模型,而不是雌性小鼠的aβ病理减少[5]。tau病理和aβ病理均表现出这种性别差异,应该不是巧合,背后可能有更隐秘的机制需要研究人员继续探索。
在研究的最后,holtzman团队发现可能是肠道微生物分泌的短链脂肪酸(scfas)参与了肠菌调节tau病理过程。单独给无菌饲养的小鼠喂scfas,会促进胶质细胞增生和tau病理。
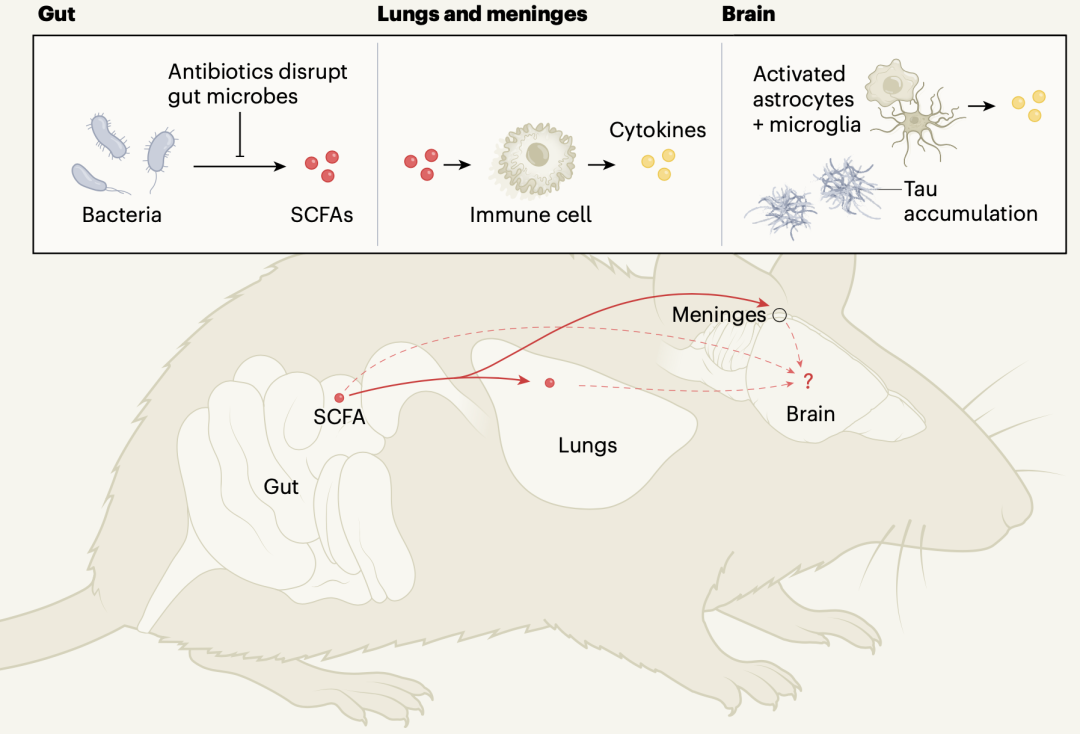
肠菌影响tau病理的机制示意图[6]
总的来说,holtzman团队这个研究证实了肠菌会促进tau病理,算是补齐了肠菌与阿尔茨海默病之间关系的一大空白,让肠菌与阿尔茨海默病的关系变得更加紧密,为通过干预肠菌预防或治疗阿尔茨海默病奠定了基础。
不过,这个研究还有留下了很多的疑问。例如,为什么无菌条件对神经的保护作用不受apoe基因型的影响,而抗生素治疗的效果却受影响?抗生素保护的性别差异究竟是为什么?
还有一个最重要的问题是,究竟是哪些肠道微生物或者哪些短链脂肪酸参与了tau病理?如果能破解这个问题,就找到了通过肠菌预防或治疗阿尔茨海默病的干预靶点。
无论如何,期待holtzman团队在这一领域的后续研究成果。
参考文献:
[1].seo do, o'donnell d, jain n, et al. apoe isoform- and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy. science. 2023;379(6628):eadd1236. doi:10.1126/science.add1236
[2].chandra s, sisodia ss, vassar rj. the gut microbiome in alzheimer's disease: what we know and what remains to be explored. mol neurodegener. 2023;18(1):9. published 2023 feb 1. doi:10.1186/s13024-023-00595-7
[3].long jm, holtzman dm. alzheimer disease: an update on pathobiology and treatment strategies. cell. 2019;179(2):312-339. doi:10.1016/j.cell.2019.09.001
[4].wang c, xiong m, gratuze m, et al. selective removal of astrocytic apoe4 strongly protects against tau-mediated neurodegeneration and decreases synaptic phagocytosis by microglia. neuron. 2021;109(10):1657-1674.e7. doi:10.1016/j.neuron.2021.03.024
[5].dodiya hb, kuntz t, shaik sm, et al. sex-specific effects of microbiome perturbations on cerebral aβ amyloidosis and microglia phenotypes. j exp med. 2019;216(7):1542-1560. doi:10.1084/jem.20182386
[6].martín-peña a, tansey mg. the alzheimer's risk gene apoe modulates the gut-brain axis. nature. 2023. doi:10.1038/d41586-023-00261-4


